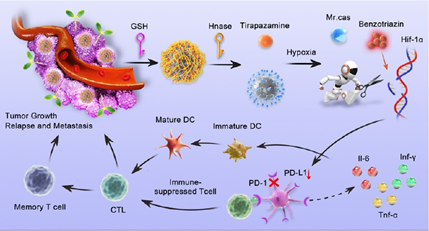
乏氧是多種實體腫瘤最典型的特征之一,其會導致免疫抑制性腫瘤微環境(immunosuppressive tumor microenvironment,TME),進而影響腫瘤治療的效果。緩解乏氧是重塑乏氧TME以提高腫瘤免疫治療的關鍵策略。然而,如何通過乏氧激活的基因編輯和前藥來實現可控的腫瘤精準治療仍是一項嚴峻的挑戰。有鑒于此,南京中醫藥大學韓欣教授、Zhaorui Sun和南京郵電大學陸峰教授將二氧化硅包被的近紅外二區(NIR-II)發射硫化銀量子點作為負載CRISPR/Cas9系統的載體,以靶向乏氧誘導因子-1(HIF-1α)和實現腫瘤靶向成像。
本文要點:
(1)為了減少在非腫瘤細胞中的脫靶效應,以更好地控制安全風險,研究者設計了TME觸發、級聯激活的納米診療平臺(AA@Cas-H@HTS),其能夠實現替拉帕胺(TPZ)前藥的乏氧激活和CRISPR/Cas9核糖核蛋白的時空可控釋放。研究發現,基因編輯和TPZ激活能夠協同耗竭HIF-1α,以顯著緩解腫瘤乏氧。
(2)實驗結果表明,靶向HIF-1α可破壞程序性細胞死亡1/程序性細胞死亡配體1(PD-1/PD-L1)信號通路,有效重塑免疫抑制性TME,激活T細胞介導的抗腫瘤免疫。綜上所述,該研究構建的TME觸發、級聯激活的納米平臺能夠通過緩解乏氧實現增強的癌癥免疫治療。
Yu Ji. et al. Triggered Cascade-Activation Nanoplatform to Alleviate Hypoxia for Effective Tumor Immunotherapy Guided by NIR-II Imaging. ACS Nano. 2024
DOI: 10.1021/acsnano.4c11334
https://pubs.acs.org/doi/10.1021/acsnano.4c11334



















