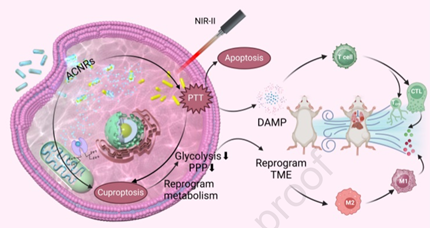
腫瘤代謝異常會導致腫瘤生長、轉移和復發。重編程腫瘤代謝和激活有效的抗腫瘤免疫應答能夠實現有效的腫瘤消除。參與銅死亡的銅基納米材料在這兩方面都表現出了廣闊的應用前景,但其效率仍受到Cu穩態和螯合劑毒性等問題的限制。有鑒于此,陸軍軍醫大學張冬教授和周春宇研究員成功制備了對pH響應的AuNRs@Cu2O核殼等離激元雜化納米棒(ACNRs),其在腫瘤部位能夠實現微環境控釋和銅死亡-光熱聯合治療。
本文要點:
(1)ACNRs內核具有優異的NIR-II光熱特性,可提高細胞內的銅濃度,以引發嚴重的銅死亡,并誘導腫瘤細胞免疫原性死亡。體內研究表明,ACNR對原發性、轉移性和復發性腫瘤均具有良好的治療作用。ACNRs誘導的銅死亡和PTT能夠重編程能量代謝,導致乳酸的產生減少。研究發現,代謝重編程有助于重塑免疫抑制性腫瘤微環境,促進免疫細胞的浸潤,增強PTT觸發的免疫應答。
(2)研究者通過代謝組學分析探究了ACNRs的治療機制。實驗結果表明,ACNRs + PTT治療可抑制腫瘤細胞的戊糖磷酸途徑和糖酵解途徑。糖酵解抑制會導致ATP的合成減少,以阻礙能量依賴性銅外排,從而能夠進一步促進銅死亡。綜上所述,該研究設計了一種基于銅死亡的癌癥治療新策略,能夠為實現納米藥物介導的代謝調節提供新的見解。
Qian Xie. et al. Responsive Plasmonic Hybrid Nanorods Enables Metabolism Reprogramming via Cuproptosis-Photothermal Combined Cancer Therapy. Biomaterials. 2024
https://www.sciencedirect.com/science/article/pii/S0142961224005064



















