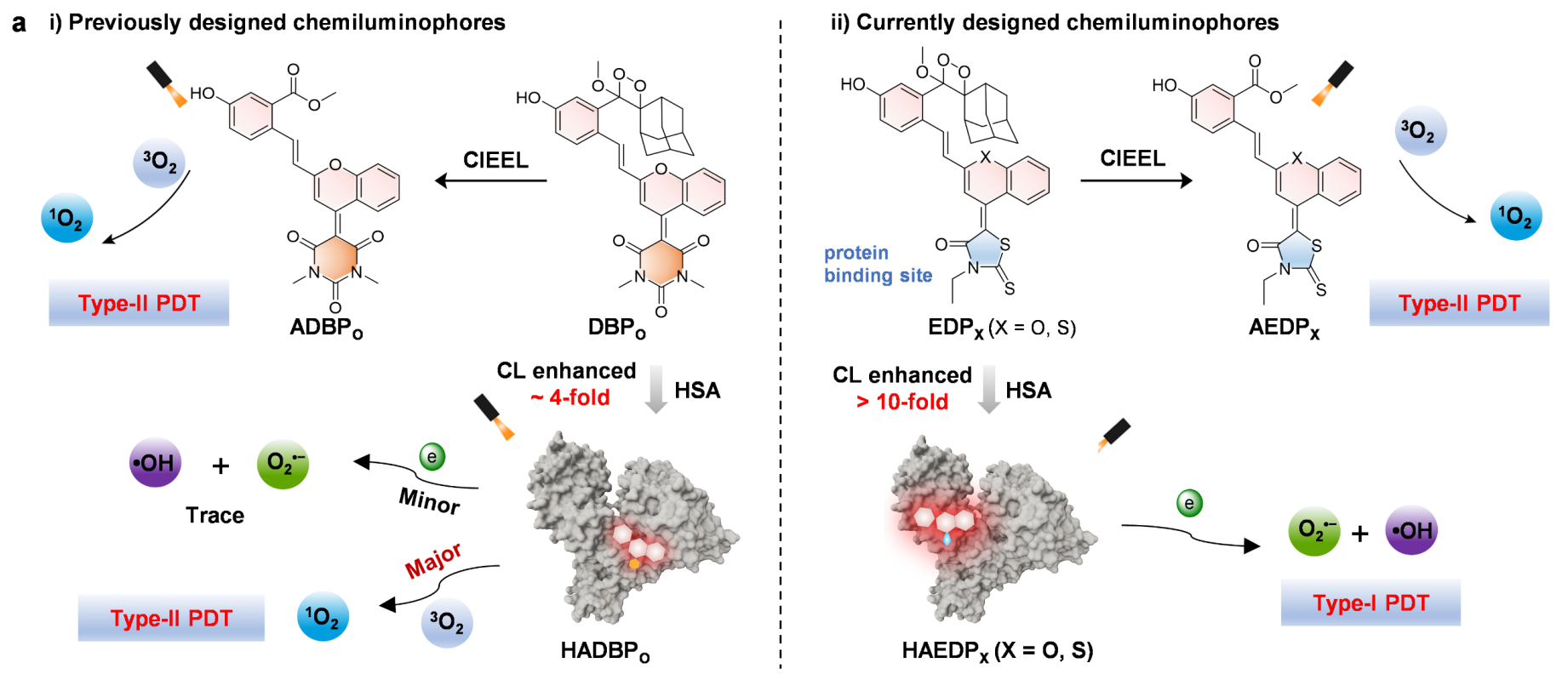
盡管光學(xué)診療藥物在癌癥治療領(lǐng)域中具有重要潛力,但其目前仍面臨兩個嚴(yán)峻挑戰(zhàn):(1)組織自身熒光導(dǎo)致的診斷敏感性有限;(2)對氧氣高度依賴的II型光動力過程的治療效果不理想。無需實時光激發(fā)的化學(xué)發(fā)光診療藥物可以解決組織自身熒光的問題,但將其用于光動力治療(PDT),尤其是氧依賴性低的I型PDT的研究目前仍鮮有報道。有鑒于此,南洋理工大學(xué)浦侃裔教授合成了能夠與人血清白蛋白(HSA)特異性結(jié)合的近紅外(NIR)化學(xué)發(fā)光團,其能夠形成化學(xué)發(fā)光團-蛋白復(fù)合物,以實現(xiàn)癌癥檢測和光動力治療。
本文要點:
(1)與HSA絡(luò)合后,該化學(xué)發(fā)光團的化學(xué)發(fā)光(CL)強度可提高10倍以上。與此同時,其光動力過程會從II型(以單線態(tài)產(chǎn)氧為主)切換為I型(以超氧陰離子和羥基自由基為主),而先前報道的與HSA發(fā)生非特異性結(jié)合的可激活化學(xué)發(fā)光團則不能切換光動力過程。
(2)基于最佳的化學(xué)發(fā)光團,研究者合成了一種硝基還原酶活化的CL探針-蛋白復(fù)合物,實驗結(jié)果表明,該復(fù)合物可在乏氧腫瘤中特異性地開啟CL和I型PDT,以實現(xiàn)精準(zhǔn)診療。綜上所述,該研究為提高化學(xué)發(fā)光團的光學(xué)診療性能提供了一個新的策略。
Jingsheng Huang. et al. Near-Infrared Chemiluminophore Switches Photodynamic Processes via Protein Complexation for Biomarker-Activatable Cancer Therapy. Angewandte Chemie International Edition. 2024
DOI: 10.1002/anie.202421962
https://onlinelibrary.wiley.com/doi/10.1002/anie.202421962



















