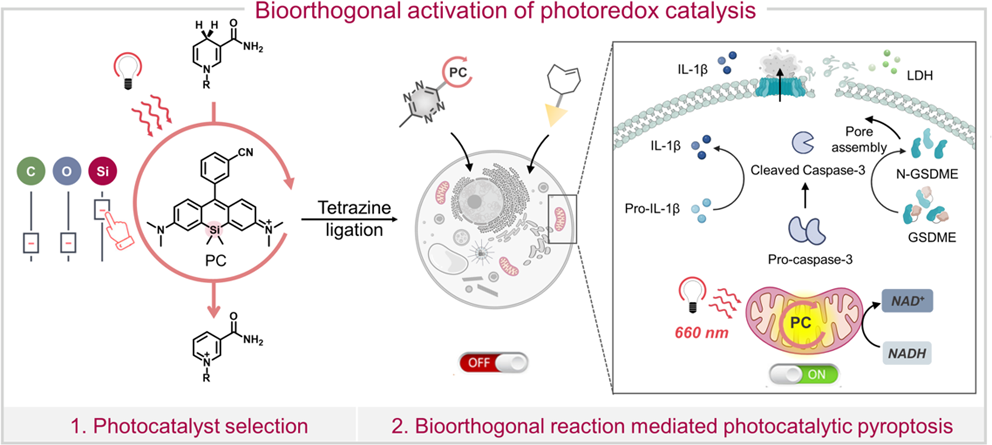
光氧化還原催化過程是一種能夠用于疾病治療和診斷的創(chuàng)新生物技術(shù)。然而,由于存在靶向性不足、與復(fù)雜生物環(huán)境的相容性低以及與光催化劑毒性相關(guān)的安全風(fēng)險等問題,因此如何將人工光氧化還原催化與生命系統(tǒng)進(jìn)行整合仍是一項嚴(yán)峻的挑戰(zhàn)。有鑒于此,高麗大學(xué)Jong Seung Kim、Yunjie Xu、愛丁堡大學(xué)Marc Vendrell、特拉華大學(xué)Joseph M. Fox、深圳大學(xué)李明樂教授和成均館大學(xué)Jin Yong Lee開發(fā)了一種生物正交活化的光氧化還原催化新方法。
本文要點:
(1)在該方法中,研究者通過替換羅丹明內(nèi)核的原子開發(fā)了生物正交活化的光催化劑(PC-Tz)。引入的1,2,4,5-四嗪能夠淬滅其光催化性能,并可與位于線粒體的反式環(huán)辛烯(TCO)發(fā)生胞內(nèi)反電子需求的Diels?Alder(iEDDA)反應(yīng),以實現(xiàn)光催化性能的恢復(fù)。研究發(fā)現(xiàn),該反應(yīng)會導(dǎo)致煙酰胺腺嘌呤二核苷酸(NADH)發(fā)生顯著的光催化氧化,進(jìn)而可在癌細(xì)胞乏氧條件下有效地操控線粒體電子傳遞鏈(ETC)。
(2)實驗結(jié)果表明,PC-Tz可通過caspase-3/gasdermin E(GSDME)通路實現(xiàn)光催化焦亡性細(xì)胞死亡,進(jìn)而能夠產(chǎn)生顯著的抗腫瘤效果,并導(dǎo)致腫瘤細(xì)胞中三磷酸腺苷(ATP)的減少。綜上所述,該研究首次實現(xiàn)了生物正交激活的光氧化還原催化,其能夠在特定的細(xì)胞器中對活性進(jìn)行時空控制,并且不會破壞其它的天然生物過程。
Jungryun Kim. et al. Bioorthogonal Activation of Deep Red Photoredox Catalysis Inducing Pyroptosis. Journal of the American Chemical Society. 2024
DOI: 10.1021/jacs.4c13131
https://pubs.acs.org/doi/10.1021/jacs.4c13131



















