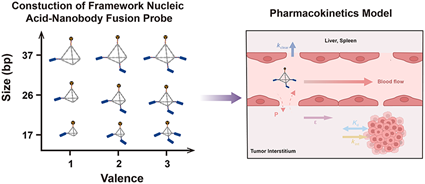
納米抗體具有優(yōu)異的抗原識(shí)別作用和腫瘤靶向性,其在免疫PET成像領(lǐng)域中具有廣闊的應(yīng)用前景。然而,快速清除等問題仍會(huì)導(dǎo)致其腫瘤積累效率受限。多聚化和白蛋白結(jié)合策略可以延長(zhǎng)納米抗體的循環(huán)時(shí)間,并提高其腫瘤靶向性。因此,研究者亟需開發(fā)一種簡(jiǎn)單、通用的方法來構(gòu)建蛋白多聚體。有鑒于此,上海交通大學(xué)譚蔚泓院士、Ding Ding和湖南大學(xué)呂一帆教授利用DNA納米技術(shù)的易合成、尺寸可控和精確組裝等優(yōu)勢(shì)構(gòu)建了具有多價(jià)和多尺寸、靶向CD47的框架核酸-納米抗體融合探針。
本文要點(diǎn):
(1)在完成結(jié)構(gòu)表征后,研究者在結(jié)直腸癌LS174T小鼠模型中進(jìn)行了體外特異性評(píng)估和體內(nèi)PET/CT成像分析。此外,研究者也建立了一個(gè)藥代動(dòng)力學(xué)模型,并進(jìn)行了大量體內(nèi)數(shù)據(jù)擬合以證明該模型的合理性,隨后也測(cè)試了改變不同藥代動(dòng)力學(xué)參數(shù)對(duì)腫瘤攝取預(yù)測(cè)的影響。
(2)實(shí)驗(yàn)結(jié)果表明,研究者可通過控制核酸支架的大小和附著的納米抗體的數(shù)量來精準(zhǔn)地調(diào)節(jié)探針在腫瘤部位的積累。綜上所述,該研究不僅開發(fā)了一種用于構(gòu)建納米體多聚體的有效策略,而且也構(gòu)建了藥代動(dòng)力學(xué)模型,其能夠?yàn)樵O(shè)計(jì)具有可預(yù)測(cè)遞送效率的成像探針提供了新的見解。
Yani Yang. et al. Framework Nucleic Acid-Nanobody Fusion Probe-Based Pharmacokinetics Modulation and Analysis for Efficient Positron Emission Tomography Imaging. ACS Nano. 2024
DOI: 10.1021/acsnano.4c09127
https://pubs.acs.org/doi/10.1021/acsnano.4c09127



















