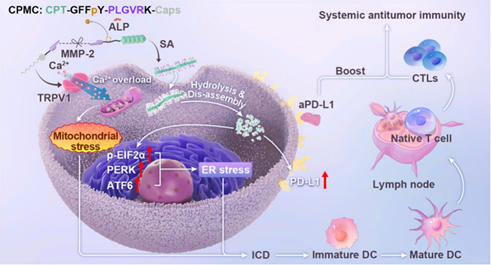
化療誘導的免疫原性細胞死亡(ICD)是一種重要的癌癥免疫治療協同方式。然而,由于大多數化療藥物難以誘導有效的ICD信號傳導,因此其產生的ICD應答也較為有限。有鑒于此,溫州醫科大學Zhi-Wen Hu和南開大學楊志謀教授開發了雙酶指導的肽自組裝平臺CPMC(CPT-GFFpY-PLGVRK-Caps),該平臺可協同利用喜樹堿(CPT)和辣椒素(Caps)促進ICD,并參與系統性適應性免疫,以實現腫瘤消退。
本文要點:
(1)盡管CPT和Caps可分別通過抑制I型DNA拓撲異構酶和激活瞬時受體電位陽離子通道亞家族V成員1(TRPV1)來阻止腫瘤進展,但兩者都不能單獨有效地刺激產生足夠的ICD信號以滿足免疫治療的需求。研究發現,CPMC可序貫實現VRK-Caps的活性Caps衍生物和CPT在細胞外和細胞內的釋放,以協同Caps和CPT刺激的兩種不同的凋亡通路,增加腫瘤免疫原性,并引發系統性T細胞免疫。
(2)實驗結果表明,CPMC可改善腫瘤特異性細胞毒性T細胞反應和產生持續的免疫記憶,以成功抑制原發性和遠端腫瘤。此外,CPMC也能夠使腫瘤對PD-L1阻斷敏感,可協同抗程序性細胞死亡配體1(aPDL1)抗體實現腫瘤抑制。綜上所述,該研究利用肽自組裝策略將兩種具有低ICD刺激能力的癌癥化療藥物進行聯合,可以顯著改善ICD反應,并增強癌癥免疫治療。
Zhenghao Zhang. et al. Dual-Enzyme-Instructed Peptide Self-Assembly to Boost Immunogenic Cell Death by Coordinating Intracellular Calcium Overload and Chemotherapy. ACS Nano. 2025
DOI: 10.1021/acsnano.4c10119
https://pubs.acs.org/doi/10.1021/acsnano.4c10119




















