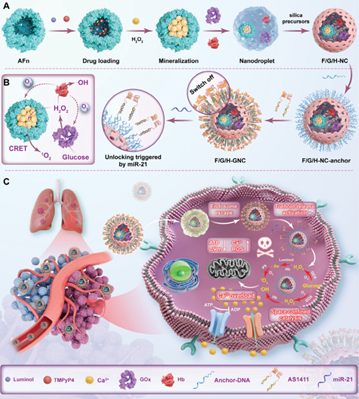
轉移是導致癌癥患者死亡的主要原因之一,也是依賴于光和氧氣的傳統(tǒng)光動力療法(PDT)面臨的一項嚴峻挑戰(zhàn)。有鑒于此,中國海洋大學姜帥教授、毛相朝教授和馬克斯普朗克高分子研究所Katharina Landfester開發(fā)了一種自維持、模擬細胞器的納米反應器,其具有可編程的DNA開關,可實現(xiàn)生物-化學-光催化級聯(lián)驅(qū)動的饑餓-光動力協(xié)同治療,以對抗腫瘤轉移。
本文要點:
(1)仿效活細胞的區(qū)室化和位置組裝等策略的納米-細胞器反應器可實現(xiàn)多個功能模塊的定量共區(qū)室化,以作為自照明化學激發(fā)的PDT系統(tǒng)。在限域的納米反應器內(nèi),生物燃料葡萄糖會被轉化為過氧化氫(H2O2),以增強基于魯米諾的化學發(fā)光(CL),進而可通過CL共振能量轉移驅(qū)動光化學單線態(tài)氧(1O2)的產(chǎn)生。與此同時,血紅蛋白可作為葡萄糖氧化和PDT的同步氧氣供體,并同時表現(xiàn)出類過氧化物酶活性,以產(chǎn)生羥基自由基(·OH)。
(2)實驗結果表明,該納米反應器在正常組織中會保持關閉,而在腫瘤中則可通過立足點介導的鏈置換反應實現(xiàn)按需激活。綜上所述,該研究設計的納米反應器可在光和氧氣等方面實現(xiàn)自給自足,并且能夠精準地打擊腫瘤,有望為治療高轉移性癌癥提供一個新的范例。
Wenshuai Han. et al. Self-Sustained Biophotocatalytic Nano-Organelle Reactors with Programmable DNA Switches for Combating Tumor Metastasis. Advanced Materials. 2025
DOI: 10.1002/adma.202415030
https://onlinelibrary.wiley.com/doi/10.1002/adma.202415030



















