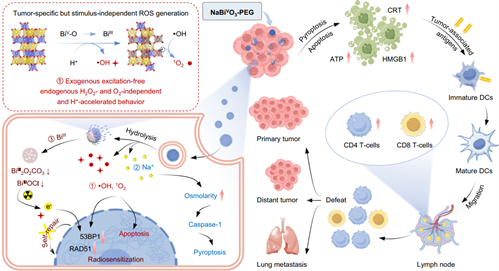
活性氧誘導(dǎo)的免疫治療在腫瘤治療領(lǐng)域中具有重要的應(yīng)用潛力。然而,依賴于外源性刺激或內(nèi)源性H2O2和O2等問(wèn)題仍會(huì)導(dǎo)致該策略的應(yīng)用受限。有鑒于此,上海交通大學(xué)李萬(wàn)萬(wàn)研究員和于緒江教授開(kāi)發(fā)了一種氧化五價(jià)鉍(V)多功能納米平臺(tái)(NaBiVO3-PEG),其能夠以一種無(wú)需外部激發(fā)、不依賴于H2O2和O2的方式產(chǎn)生活性氧。
本文要點(diǎn):
(1)在腫瘤微環(huán)境中,NaBiVO3-PEG可通過(guò)電子轉(zhuǎn)移介導(dǎo)的BiV到BiIII的轉(zhuǎn)化和晶格氧轉(zhuǎn)化經(jīng)歷連續(xù)的H+加速水解,以生成?OH和1O2。被內(nèi)吞后,同時(shí)釋放的鈉抗衡離子可觸發(fā)caspase-1介導(dǎo)的細(xì)胞焦亡。研究發(fā)現(xiàn),瘤內(nèi)給藥NaBiVO3-PEG能夠?qū)υl(fā)和遠(yuǎn)端腫瘤產(chǎn)生強(qiáng)大的治療效果,并激活全身免疫反應(yīng),以對(duì)抗腫瘤轉(zhuǎn)移。
(2)靜脈給藥后,NaBiVO3-PEG可在腫瘤部位有效積累,以實(shí)現(xiàn)實(shí)時(shí)的CT監(jiān)測(cè)、免疫治療或協(xié)同的免疫-放射治療。綜上所述,該研究工作開(kāi)發(fā)了一種基于高價(jià)鉍(V)納米平臺(tái)的納米藥物,其在癌癥免疫治療領(lǐng)域中具有廣闊的應(yīng)用前景。
Yizhang Tang. et al. A high-valence bismuth(V) nanoplatform triggers cancer cell death and anti-tumor immune responses with exogenous excitation-free endogenous H2O2- and O2-independent ROS generation. Nature Communications. 2025
https://www.nature.com/articles/s41467-025-56110-7



















