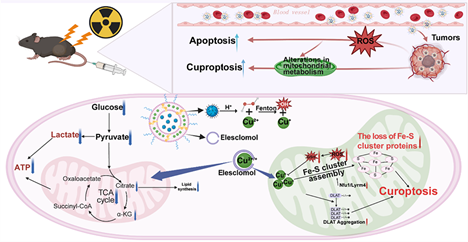
放射治療是治療局部腫瘤的重要策略之一。腫瘤細胞可通過提高細胞內(nèi)的銅水平促進腫瘤生長和抵抗輻射。因此,實現(xiàn)靶向線粒體的銅遞送可以通過誘導(dǎo)腫瘤細胞銅死亡增強放射治療。有鑒于此,上海交通大學(xué)張琴教授、上海大學(xué)陳雨教授、同濟大學(xué)丁利研究員和復(fù)旦大學(xué)Sheng Wang設(shè)計了一種多功能納米脂質(zhì)體復(fù)合物L(fēng)ipo-Ele@CuO2,其封裝了過氧化銅(CuO2)和銅螯合劑伊利司莫,可以將銅離子遞送到線粒體。
本文要點:
(1)Lipo-Ele@CuO2復(fù)合物可誘導(dǎo)線粒體介導(dǎo)的腫瘤細胞銅死亡,以協(xié)同增強放療的療效。作為銅供體的CuO2能夠?qū)λ嵝原h(huán)境表現(xiàn)出固有的敏感性。此外,CuO2也可以消耗細胞內(nèi)的谷胱甘肽,進而使細胞對銅死亡敏感。研究發(fā)現(xiàn),Lipo-Ele@CuO2可利用其在酸性腫瘤微環(huán)境中的pH響應(yīng)特性促進伊利司莫的可控釋放,從而能夠在腫瘤部位將銅離子有效遞送到線粒體。
(2)體內(nèi)外實驗結(jié)果表明,基于Lipo-Ele@CuO2的療法具有顯著增強的抗腫瘤療效和良好的安全性,可有效誘導(dǎo)腫瘤細胞銅死亡,提高放射治療的有效性。代謝組學(xué)和轉(zhuǎn)錄組學(xué)的分析結(jié)果表明,該聯(lián)合治療策略會導(dǎo)致腫瘤能量代謝發(fā)生顯著變化,抑制與鐵-硫簇組裝和糖酵解相關(guān)的基因,從而進一步證實了銅死亡的誘導(dǎo)。綜上所述,該研究設(shè)計的治療策略能夠為解決臨床放療耐藥性提供一個可行、具有轉(zhuǎn)化潛力的新方法。
Tiaoyan Jiang. et al. Cuproptosis-Inducing Functional Nanocomposites for Enhanced and Synergistic Cancer Radiotherapy. ACS Nano. 2025
DOI: 10.1021/acsnano.4c13753
https://pubs.acs.org/doi/10.1021/acsnano.4c13753




















