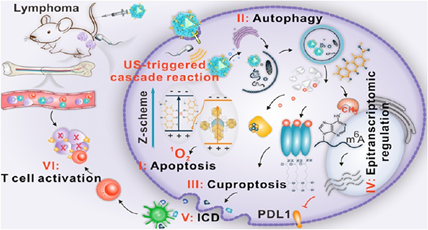
B細(xì)胞淋巴瘤(BCL)是一種血液系統(tǒng)惡性腫瘤,具有高度的異質(zhì)性,與成熟B細(xì)胞的侵襲性增殖有關(guān)。盡管傳統(tǒng)的治療方法在臨床實(shí)驗(yàn)中取得了初步成功,但大多數(shù)患者往往會(huì)產(chǎn)生治療耐藥性,進(jìn)而導(dǎo)致臨床結(jié)果不佳。表觀遺傳失調(diào)是BCL發(fā)病機(jī)制中的主要因素之一,靶向表觀遺傳通路的療法有望成為治療BCL的替代策略。有鑒于此,吉林大學(xué)閆飛教授開發(fā)了一種基于金屬-有機(jī)框架(MOF)的納米聲敏劑,并將其用于實(shí)現(xiàn)超聲驅(qū)動(dòng)的BCL級(jí)聯(lián)免疫治療。
本文要點(diǎn):
(1)實(shí)驗(yàn)將m6A-mRNA去甲基酶抑制劑的銅配合物包裹在UiO-66-NH2中,合成了納米聲敏劑。該納米聲敏劑具有Z型異質(zhì)結(jié)構(gòu),可在超聲激活下有效地分離電子-空穴對(duì),以產(chǎn)生活性氧(ROS)。隨后,研究者利用mPEG-PO3和抗CD19抗體對(duì)CuR@UiO66聲敏劑進(jìn)行功能化,以構(gòu)建得到CRUPPA19顆粒,其可以在BCL組織中特異性積聚,并且能夠靶向浸潤(rùn)到骨髓的淋巴瘤細(xì)胞。被內(nèi)化后,CRUPPA19可以在超聲照射下誘導(dǎo)產(chǎn)生胞內(nèi)ROS和實(shí)現(xiàn)細(xì)胞凋亡。
(2)隨后,超聲刺激可觸發(fā)自噬介導(dǎo)的CRUPPA19釋放Cu和Rhein,以增加蛋白質(zhì)脂化和整體mRNA甲基化,進(jìn)而可分別導(dǎo)致銅死亡和轉(zhuǎn)錄抑制PDL1。這些級(jí)聯(lián)效應(yīng)能夠在腫瘤中協(xié)同誘導(dǎo)免疫原性細(xì)胞死亡,并促進(jìn)CD8+ T細(xì)胞的活化,以產(chǎn)生抗淋巴瘤免疫應(yīng)答。實(shí)驗(yàn)結(jié)果表明,CRUPPA19介導(dǎo)的超聲免疫療法不僅可以消除原發(fā)性和轉(zhuǎn)移性淋巴瘤,還能夠清除骨髓中的淋巴瘤細(xì)胞。綜上所述,該研究開發(fā)了一種基于MOF的納米表觀遺傳治療平臺(tái),該平臺(tái)具有超聲觸發(fā)的級(jí)聯(lián)放大功能,可增強(qiáng)抗血液腫瘤免疫。
Zhihua Wang. et al. UiO-66 MOFs-Based “Epi-Nano-Sonosensitizer” for Ultrasound-Driven Cascade Immunotherapy against B?Cell Lymphoma. ACS Nano. 2025
DOI: 10.1021/acsnano.4c15761
https://pubs.acs.org/doi/10.1021/acsnano.4c15761



















