放療(RT)調節適應性抗腫瘤免疫的失敗通常與組織修復巨噬細胞的募集有關。盡管訓練這些巨噬細胞去吞噬RT后的癌細胞可以逆轉它們的促腫瘤表現,但被吞噬的腫瘤抗原仍被嚴重低估。調節腫瘤抗原的處理和提呈是腫瘤免疫原性的關鍵決定因素,其可以從根本上影響適應性免疫反應。有鑒于此,澳門大學代云路教授和Chu-Xia Deng構建了一種簡單的鋁樣佐劑(MgAl基水滑石,bLDH),其可通過巨噬細胞誘導抗原交叉提呈以改善放射免疫治療,并且不依賴于表型。
本文要點:
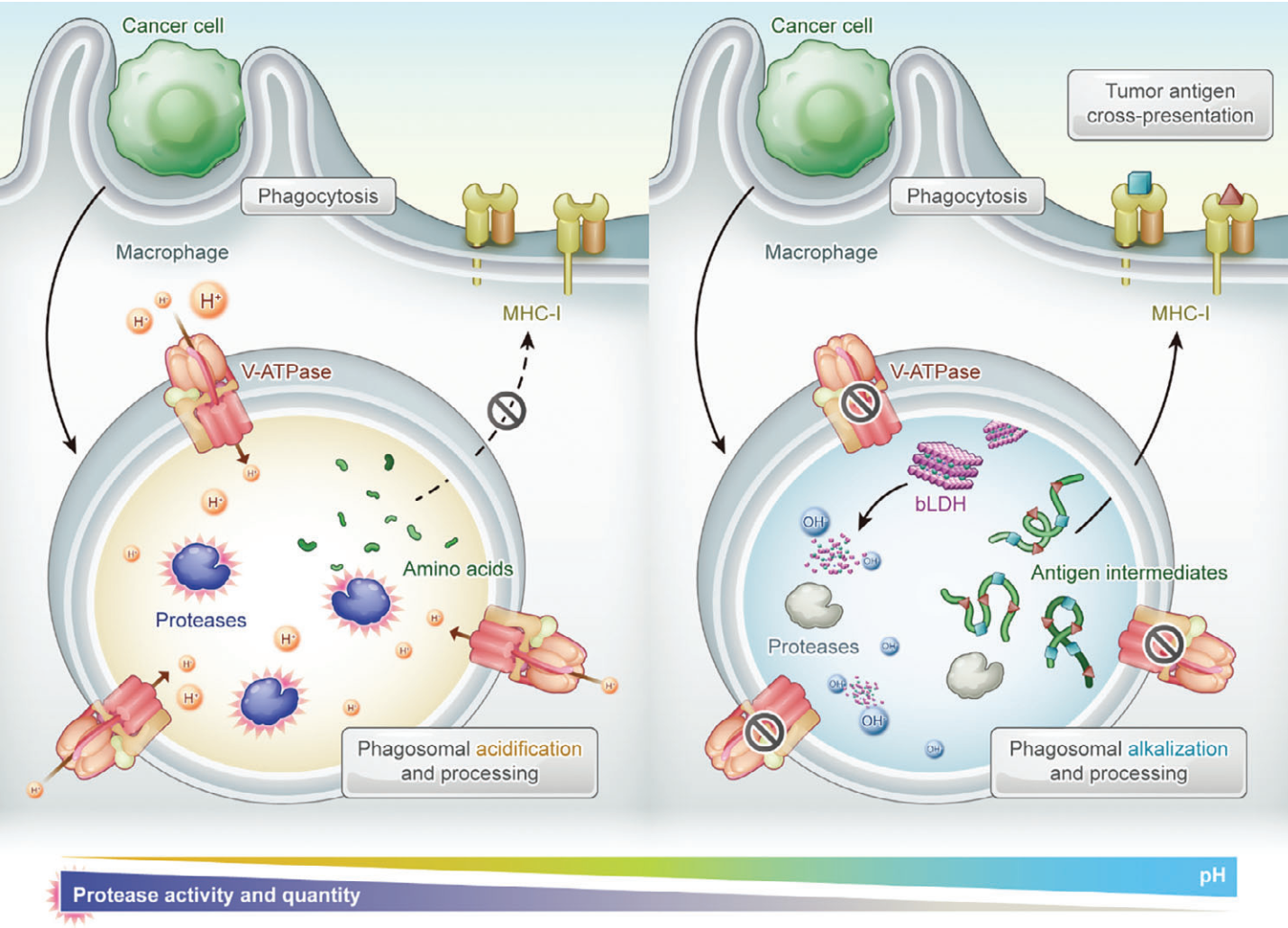
(1)胞苷單磷酸鳥苷寡脫氧核苷酸可誘導巨噬細胞吞噬被輻照的癌細胞。然而,作為半專業抗原提呈細胞的巨噬細胞具有強大的蛋白水解功能,不利于抗原提呈。研究發現,堿性bLDH可通過防止由液泡型ATP酶質子泵引起的吞噬體酸化減輕具有酸性pH最佳條件的吞噬酶體蛋白酶的活性。因此,佐劑調節的吞噬溶酶體能夠限制抗原降解,并將腫瘤抗原的交叉提呈增強十倍以上。
(2)在體內乳腺腫瘤模型中,經過訓練的巨噬細胞可成功地交叉啟動抗原特異性CD8+ T細胞,以抑制與RT相關的轉移。綜上所述,該研究工作充分證明了佐劑在精準免疫治療中的作用,并進一步強調了交叉呈遞巨噬細胞在放射免疫治療中的積極貢獻。
Bei Li. et al. Alkaline Adjuvant Regulates Proteolytic Activity of Macrophages for Antigen Cross-Presentation and Potentiates Radioimmunotherapy. Advanced Materials. 2025
DOI: 10.1002/adma.202416690
https://advanced.onlinelibrary.wiley.com/doi/10.1002/adma.202416690



















