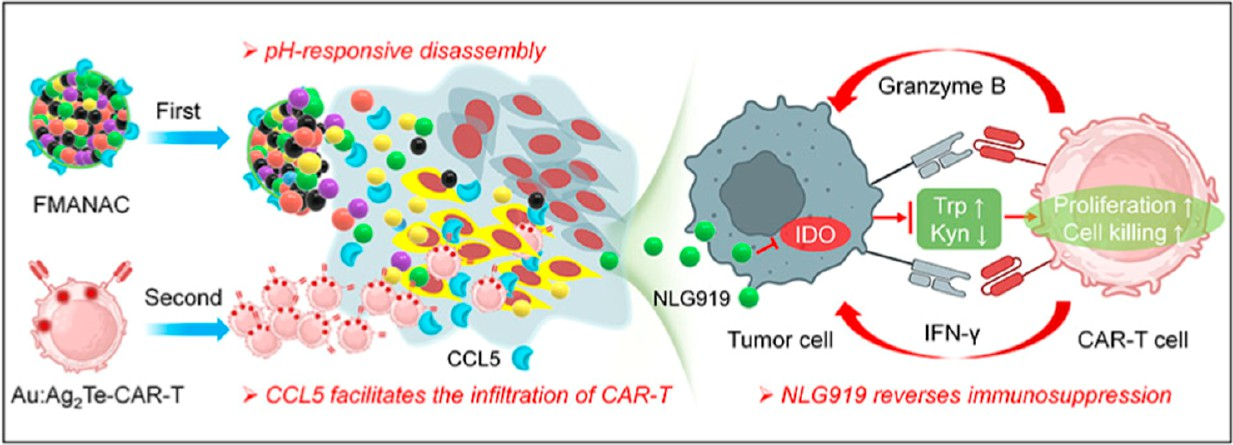
嵌合抗原受體(CAR)-T細胞在治療血液癌癥方面具有顯著的療效。然而,由于受到免疫抑制腫瘤微環境(TME)的限制,因此CAR-T細胞在實體腫瘤治療中的應用仍面臨嚴峻挑戰。開發安全有效的TME調控策略對于增強腫瘤的過繼性細胞免疫治療具有重要意義。有鑒于此,中國科學院蘇州納米所王強斌研究員和李春炎研究員采用多組分協同自組裝的方法設計了TME響應性納米免疫調節劑(FMANAC),其可重建免疫趨化因子梯度,克服對CAR-T細胞免疫活性的抑制,以提高CAR-T細胞在腫瘤內的浸潤和殺傷效率。
本文要點:
(1)酸性TME可誘導FMANAC分解,以實現藥物釋放。研究發現,C-C趨化因子配體5(CCL5)能夠改善腫瘤內被破壞的趨化梯度,以增加CAR-T細胞的募集和向深部組織的浸潤。NLG919則可以逆轉吲哚胺2,3-雙加氧酶(IDO)介導的TME免疫抑制,為CAR-T細胞發揮殺傷功能創造有利環境。
(2)在H460肺癌動物模型中,該納米調控策略可通過結合工程化CD276 CAR-T細胞實現多路近紅外二區熒光成像指導的程序化給藥,顯著提高腫瘤治療效果。
Qian Chen. et al. Tumor Microenvironment-Responsive NanoImmunomodulators for Enhancing Chimeric Antigen Receptor?T Cell Therapy in Lung Cancer. ACS Nano. 2025
DOI: 10.1021/acsnano.4c17899
https://pubs.acs.org/doi/10.1021/acsnano.4c17899




















