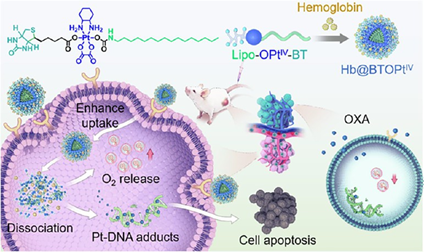
鉑(Pt)基化療藥物具有強大的細胞毒性,已被廣泛用于臨床腫瘤治療。然而,該藥物的治療效果仍會受到多種因素的限制。乏氧腫瘤微環境(TME)不僅會阻礙藥物的有效遞送,還會引發免疫抑制,以進一步降低Pt藥物的抗腫瘤作用。有鑒于此,青島大學魏登帥教授開發了一種靶向生物素受體(BR)的奧沙利鉑(OXA)基PtIV前藥Lipo-OPtIV-BT,其可以封裝作為氧氣載體的血紅蛋白(Hb),以形成負載PtIV的脂質納米顆粒(Hb@BTOPtIV)。
本文要點:
(1)Hb@BTOPtIV可通過有效增加TME中的局部氧張力雙重解決藥物遞送不良和免疫抑制等問題。研究發現,靶向BR的PtIV前藥的細胞毒性作用和增加的氧氣水平可協同逆轉腫瘤免疫微環境,提高抗腫瘤療效。此外,Hb@BTOPtIV也可顯著改善藥物的生物分布,使其能夠在腫瘤區域優先積累。
(2)在TME中,增強的氧合作用有助于重塑腫瘤的免疫景觀,促進更有利的免疫環境,以實現有效的化療。細胞毒性T細胞浸潤的增加和腫瘤內調節性T細胞(Tregs)水平的降低等結果證明了該納米藥物可成功逆轉免疫抑制。綜上所述,該研究構建的BR靶向脂質PtIV前藥兩親體可顯著改善腫瘤部位的藥物積累,其在對抗腫瘤乏氧誘導的免疫抑制等方面具有重要潛力。
Kaichuang Sun. et al. Biotin Receptor-Targeting PtIV Oxygen Carrying Prodrug Amphiphile for Alleviating Tumor Hypoxia Induced Immune Chemotherapy Suppression. ACS Nano. 2025
DOI: 10.1021/acsnano.5c00691
https://pubs.acs.org/doi/10.1021/acsnano.5c00691



















