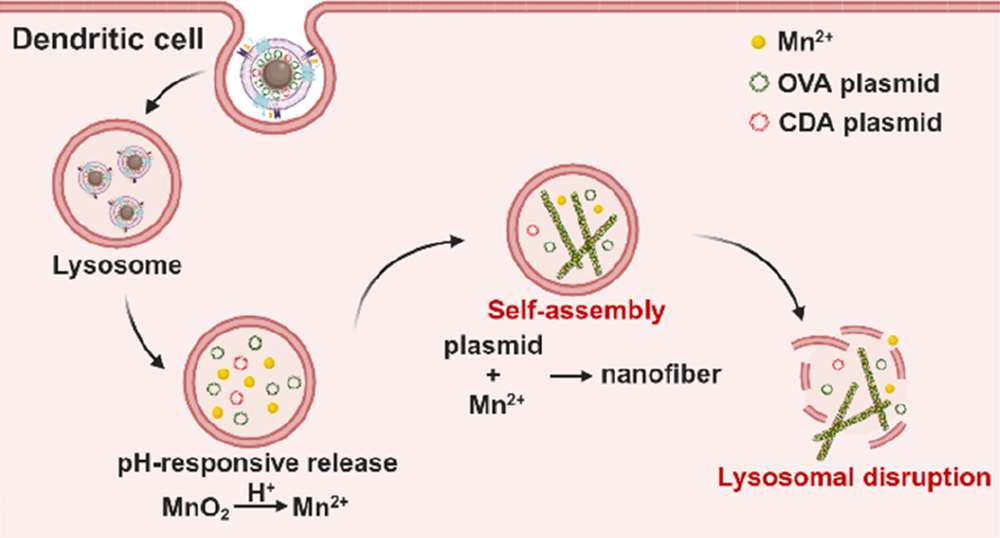
雖然基于核酸的癌癥疫苗具有治療潛力,但溶酶體包裹引起的細胞質遞送效率低等問題仍會導致其免疫原性受限。天津大學張育淼教授發現,編碼抗原和STING激動蛋白佐劑的質粒可以在錳離子的觸發作用下自組裝成配位納米纖維,并基于此構建了一種DNA疫苗(MnO2-OVA-CDA-mem),其由樹突狀細胞(DC)膜共包封的二氧化錳(MnO2)、表達抗原的質粒(編碼卵清蛋白,OVA)和表達佐劑酶的質粒(編碼STING激動劑,CDA)所組成。
本文要點:
(1)在進入酸性溶酶體后,MnO2釋放的Mn2+可觸發核酸發生從納米球(直徑~ 180 nm)到納米纖維(長度~ 1 μm)的形態變化,導致其機械強度增加約9倍,以破壞溶酶體膜。
(2)細胞質中的抗原OVA和佐劑Mn2+、CDA可觸發有效的DC活化以及抗原特異性CD8+ T細胞金屬免疫應答,以顯著抑制B16-OVA腫瘤的生長,并誘導產生長期的免疫記憶。綜上所述,該研究利用金屬驅動的原位自組裝策略構建的MnO2-OVA-CDA-mem具有作為核酸抗原和佐劑遞送平臺的重要潛力,其可通過刺激響應和可編程的方式實現癌癥金屬免疫治療。
Jiexin Li. et al. Manganese-Driven Plasmid Nanofibers Formed In Situ for Cancer Gene Delivery and Metalloimmunotherapy. Journal of the American Chemical Society. 2025
DOI: 10.1021/jacs.4c18511
https://pubs.acs.org/doi/10.1021/jacs.4c18511



















