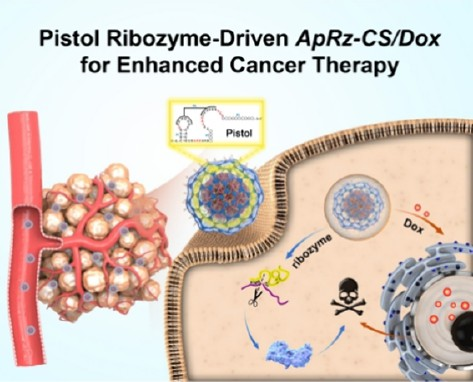
具有高特異性和低毒性的基因靶向療法有望能夠徹底改變癌癥治療的方式。作為獨立的基因治療藥物的核酶可以直接切割靶mRNA。手槍型核酶發現于2015年,其具有緊湊的結構和強大的裂解活性,能夠在生理條件下實現RNA沉默,但其臨床應用仍會受到核酸酶易感性和生物屏障穿透等問題的限制。有鑒于此,南開大學劉藝錦研究員將工程化手槍型核酶整合到球形核酸(SNA)納米載體中,開發了一種新型的基因調控策略。
本文要點:
(1)建立在DNA核-殼框架上的催化SNA納米載體能夠將核酶與阿霉素(Dox)進行結合,以形成ApRz-CS/Dox納米平臺。ApRz-CS/Dox具有均聚化DNA內核和網狀DNA外殼,可增強穩定性。研究發現,排列在ApRz-CS/Dox表面的腫瘤靶向適配體能夠將其特異性地引導到癌細胞。
(2)在靶細胞內,ApRz-CS/Dox可響應過表達的miR-21以釋放核酶,促進polo樣激酶1mRNA的裂解。綜上所述,該研究設計的綜合方法可有效地集成基因治療和Dox化療,有望能夠解決新開發的核酸藥物的遞送所面臨的相關挑戰,為增強癌癥治療提供了一種新的策略。
Jingjing Zhang. et al. Pistol Ribozyme-Driven Catalytic Spherical Nucleic Acid Integrates Gene and Chemotherapy for Enhanced Cancer Therapy. Journal of the American Chemical Society. 2025
DOI: 10.1021/jacs.4c16613
https://pubs.acs.org/doi/10.1021/jacs.4c16613




















