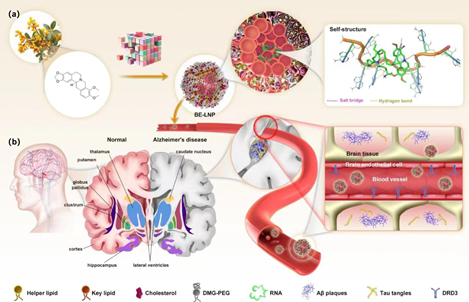
脂質(zhì)納米顆粒可成功靶向肝、脾和肺等主要器官,但其難以穿過(guò)血腦屏障(BBB)。開(kāi)發(fā)有效的腦靶向遞送系統(tǒng)對(duì)于推動(dòng)神經(jīng)系統(tǒng)疾病的基因治療的發(fā)展至關(guān)重要,但該策略目前仍面臨遞送效率低以及核酸穩(wěn)定性差等問(wèn)題的限制。有鑒于此,西南大學(xué)李翀教授和澳門科技大學(xué)姜志宏教授構(gòu)建了基于原小檗堿生物堿的四氫異喹啉結(jié)構(gòu)的可電離脂質(zhì)庫(kù),旨在通過(guò)多巴胺D3受體介導(dǎo)的內(nèi)吞作用改善對(duì)BBB的滲透性。
本文要點(diǎn):
(1)該納米顆粒具有三個(gè)重要優(yōu)勢(shì):(1)增強(qiáng)的大腦攝取、(2)通過(guò)聚(A)自組裝改善的核酸穩(wěn)定性以及(3)固有的神經(jīng)保護(hù)特性和極低的免疫原性。
(2)在小鼠模型中,該納米顆粒能夠表現(xiàn)出治療阿爾茨海默病、膠質(zhì)瘤和隱球菌性腦膜炎的重要潛力。綜上所述,該研究受小檗堿啟發(fā)而構(gòu)建的遞送系統(tǒng)集成了精準(zhǔn)的受體靶向和核酸穩(wěn)定化等功能,有望為腦靶向治療提供一個(gè)新的平臺(tái)。
Xufei Bian. et al. Berberine-inspired ionizable lipid for self-structure stabilization and brain targeting delivery of nucleic acid therapeutics. Nature Communications. 2025
https://www.nature.com/articles/s41467-025-57488-0



















