小干擾RNA(siRNA)是一種重要的治療工具,其具有基因沉默的能力。為了開發用于治療脈絡膜新生血管(CNV)的siRNA療法,上海交通大學Jing Wang、浙江大學陳麒先教授、遼寧省腫瘤醫院趙巖教授和大連醫科大學陳璽亦教授將siRNA與膜穿透性七氟丙基和靶向年齡相關性黃斑退化的環狀Arg-Gly-Asp(RGD)肽的雙功能單元進行結合,旨在通過跨細胞運輸進入到細胞內部。
本文要點:
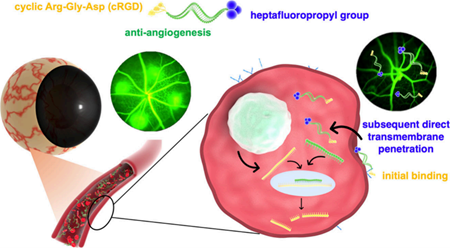
(1)在病理性CNV中,環狀RGD能夠對血管生成內皮細胞表現出選擇性親和性。具有疏脂和疏水特性的功能化七氟丙基可通過不依賴于能量的跨細胞運輸行為直接從細胞外區室進入到細胞質,即非胞吞途徑。該行為能夠避免內溶酶體包裹的缺點(生物脆弱性基因組療法面臨的關鍵威脅),從而有助于在受影響的細胞中實現有效的基因敲除。為了治療CNV,研究者構建了經過適當化學修飾的siRNA組合,以靶向敲低血管生成性VEGF-A和VEGF-R2。
(2)實驗結果表明,該siRNA組合可有效減少血管滲漏,能夠使CNV病變的平均面積顯著減少67.3%。研究者進一步通過生物信息學分析揭示了該抗VEGF療法產生的多種治療收益,其不僅可以抑制血管生成,還能夠調節白細胞跨內皮遷移、視黃醇代謝和雌激素信號通路。綜上所述,該研究設計的siRNA偶聯策略能夠將大分子生物有效載荷直接胞內運輸到細胞質,有望為實現不透膜的生物脆弱性生物治療藥物的跨細胞運輸開辟一條新的途徑。
Tongqi Li. et al. Direct Cytosolic Delivery of siRNA Conjugates: A Paradigm in Antiangiogenic Therapy for Choroidal Neovascularization. ACS Nano. 2025
DOI: 10.1021/acsnano.4c18924
https://pubs.acs.org/doi/10.1021/acsnano.4c18924




















