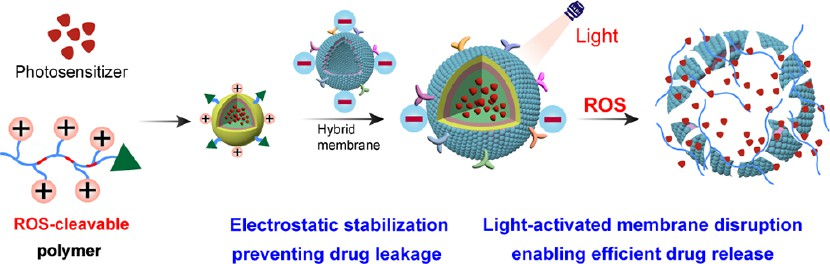
基于細胞膜包被納米顆粒的給藥系統往往會在給藥過程中產生不可避免的藥物泄漏以及在腫瘤部位的藥物釋放效率低下等問題,導致抗腫瘤效果不夠理想。有鑒于此,華東理工大學王琪教授設計了一種靜電穩定的光激活膜遞送系統(混合膜納米顆粒,[Hm]@NPs),并將其用于實現無泄漏的藥物遞送和精準的位點特異性藥物可控釋放,以提高對癌癥的治療效果。
本文要點:
(1)實驗將聚集誘導發光(AIE)光敏劑(Phe-Qui-T)封裝在帶正電的活性氧(ROS)響應性聚合物(F127-TP-U11)中,以形成帶正電的納米顆粒,然后在其表面包裹一層帶負電的混合膜(包含紅細胞膜和Panc-1細胞膜),從而構建了[Hm]@NPs。研究發現,具有高穩定性的[Hm]@NPs可通過雜化膜與納米顆粒之間的靜電相互作用有效防止藥物泄漏。
(2)與此同時,光敏劑Phe-Qui-T可通過光控ROS生成有效破壞ROS響應性聚合物和雜化膜,以確保實現精準、充分的藥物釋放和同步的光動力治療(PDT),增強抗腫瘤療效。在胰腺癌小鼠模型中,[Hm]@NPs能夠表現出優異的腫瘤抑制作用,綜上所述,該研究設計的光控膜破壞策略能夠為設計先進的細胞膜包覆納米遞送系統提供新的見解。
Cuiyun Zhang. et al. Electrostatically Stabilized Light-Activated Membrane Delivery System: Overcoming Membrane Flexibility and Self-Repair to Enhance Tumor Therapy. ACS Nano. 2025
DOI: 10.1021/acsnano.4c18518
https://pubs.acs.org/doi/10.1021/acsnano.4c18518



















