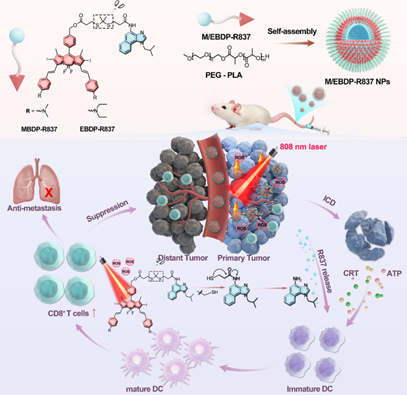
光激活前藥因其時空可控性和毒副作用低等優點而被廣泛應用于腫瘤精準治療。然而,目前研究所報道的前藥仍會受到紫外光和可見光區域的限制,導致其在深部組織中的應用嚴重受限。如何開發一種近紅外(NIR)光激活的釋放系統成為了一項嚴峻挑戰。有鑒于此,蘇州大學鐘志遠教授、林文孩研究員和李盛亮教授以咪喹莫特(R837)和近紅外硼二吡咯亞甲基(BODIPY)為原料,通過可由活性氧(ROS)切割的連接子構建了808 nm光激活的前藥,并將其用于實現對“冷”腫瘤的光免疫治療。
本文要點:
(1)在808 nm激光照射下,BODIPY產生的ROS可切割連接子,以促進R837在腫瘤部位被時空釋放。
(2)實驗結果表明,R837產生的免疫應答與光學治療引起的免疫原性細胞死亡相結合能夠顯著增強適應性抗腫瘤免疫,增強細胞毒性CD8+ T細胞浸潤,以抑制腫瘤轉移和遠端腫瘤的生長。綜上所述,該研究構建的近紅外光激活控釋系統能夠為實現腫瘤免疫治療和腫瘤轉移抑制提供一種新的策略。
Jiaping Shen. et al. Near-Infrared Light-Responsive Immunomodulator Prodrugs Rejuvenating Immune Microenvironment for “Cold” Tumor Photoimmunotherapy. Angewandte Chemie International Edition. 2025
DOI: 10.1002/anie.202425309
https://onlinelibrary.wiley.com/doi/10.1002/anie.202425309



















