
人工金屬酶(Artificial metalloenzymes)和光酶(photoenzymatic)催化是創造新型酶促反應活性的兩種先進的方法。但是,將這兩種策略結合用于對映體控制的生物轉化的潛力仍有待深入研究。
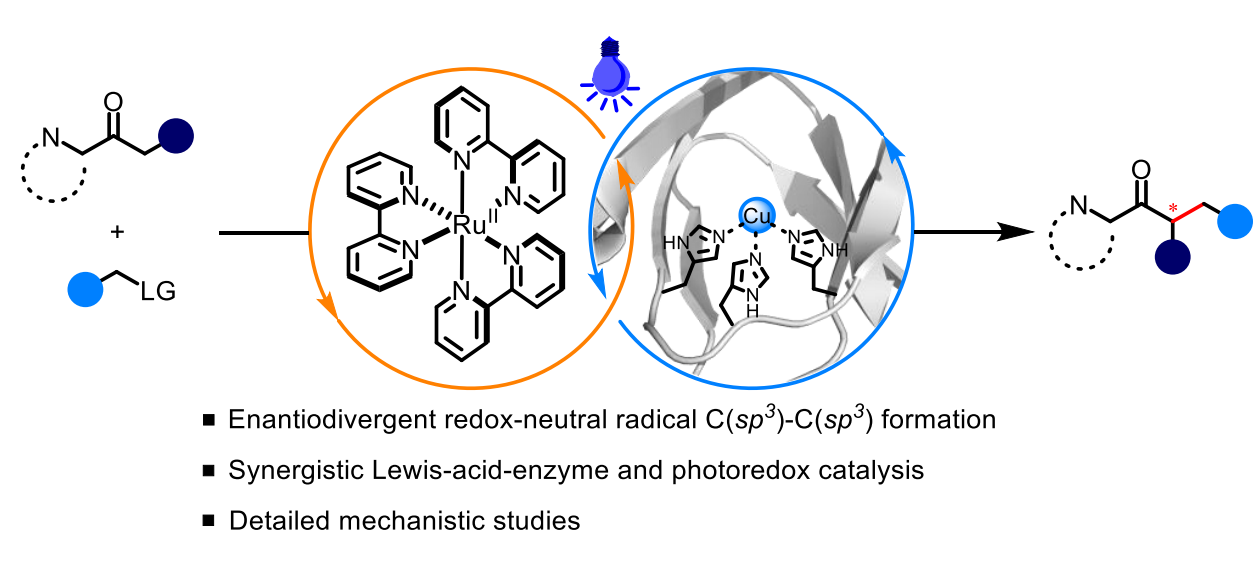
有鑒于此,南京大學黃小強教授、廈門大學王斌舉教授等報道開發了一個金屬酶與光氧化還原協同催化的平臺,實現了2-酰基咪唑(2-acyl imidazoles)的對映發散性自由基烷基化反應。
本文要點:
(1)
對cupin蛋白進行重新設計,使其能夠實現Cu(II)-Lewis酸酶(Lases,Lewis-acid-enzymes)發揮作用。這個酶與Ru(bpy)3的光氧化還原催化協同作用,能夠精確控制非生物自由基的產生、反應活性和選擇性,從而打開了非天然的酶促進反應活性。
通過蛋白質工程,經過重新設計(repurposed photo-LAses)的光-Lewis酶LAses能夠以高對映選擇性(兩種對映體均可獲得,產率高達97%,對映體比例達到98.5:1.5)實現多種富含立體結構的α-手性酮的綠色高效合成。
(2)
通過深入詳細的機理研究,表明該反應一條向金屬酶烯醇鹽中間體進行自由基加成的反應途徑,并且解釋了沒有光的反應條件變成光照條件下選擇性發生轉變的原因。
參考文獻
Jiawei Zhang, Qiaoyu Zhang, Ran Ge, Aokun Liu, Bin Chen, Zihan Zhang, Beibei Zhao, Jinhai Yu, Yue Zhao, Lu Yu, Mingfeng Cao, Binju Wang, Xiaoqiang Huang, Enantiodivergent Radical Alkylation by Synergistic Lewis-Acid-Enzyme and Photoredox Catalysis, Angew. Chem. Int. Ed. 2025
DOI: 10.1002/anie.202500338
https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.202500338


















