免疫治療是抑制腫瘤轉移的有力武器。然而,免疫抑制性腫瘤微環境(TME)仍會導致免疫治療的療效顯著降低。有鑒于此,同濟大學謝冬教授、東華大學文玫博士和陳志鋼教授構建了具有鈣過載和光-聲敏化能力的仿生納米框架,其可通過激活多重免疫抑制腫瘤轉移。
本文要點:
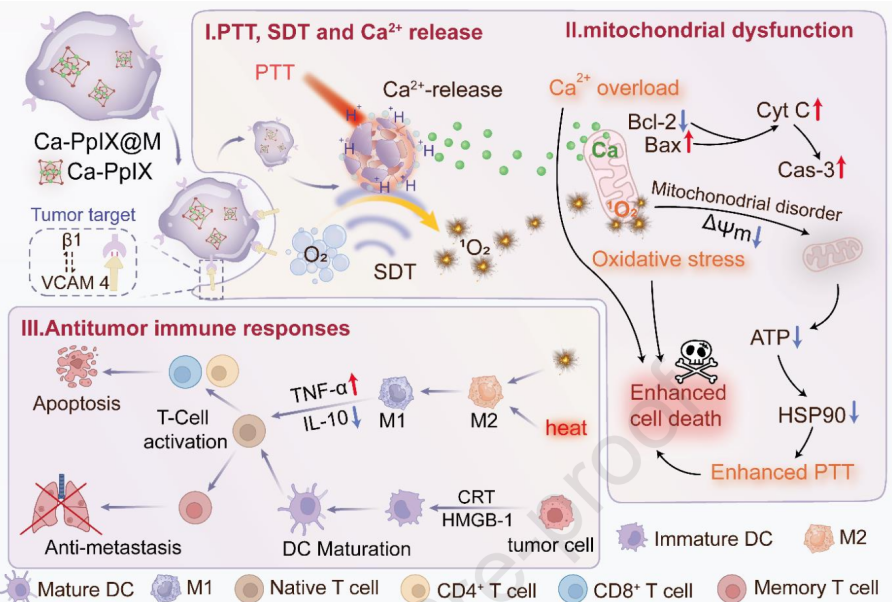
(1)實驗將Ca2+離子和原卟啉IX(PpIX)組裝成納米框架(Ca-PpIX),并進一步包封M1巨噬細胞膜,制備了一種仿生納米框架(Ca-PpIX@M)。在外部近紅外光和超聲的刺激下,其能夠表現出具有pH依賴性的Ca2+離子釋放、1O2生成和光熱轉換等性能。Ca2+過載和升高的1O2會引起細胞內的氧化應激,導致線粒體功能障礙。研究發現,線粒體功能障礙會誘導三磷酸腺苷(ATP)水平降低,抑制HSP90表達,進而能夠提高光熱消融的療效。
(2)光-聲敏化對巨噬細胞具有復極化作用,能夠使巨噬細胞M1/M2比值從0.25增加到2.45,其效率也優于單一的激發模式。實驗結果表明,Ca-PpIX@M可以誘導免疫原性細胞死亡,促進樹突狀細胞成熟(30.2%),并激活細胞毒性T細胞(12.4%)和輔助性T細胞(19.7%),增強體內抗腫瘤免疫,顯著抑制腫瘤的生長和轉移。綜上所述,該研究工作能夠為開發仿生納米框架以逆轉TME和激活多重免疫提供新的重要見解。
Yinjing Shen. et al. M1-macrophage membrane-camouflaged nanoframeworks activate multiple immunity via calcium overload and photo-sonosensitization. Biomaterials. 2025
https://www.sciencedirect.com/science/article/pii/S0142961225002066



















