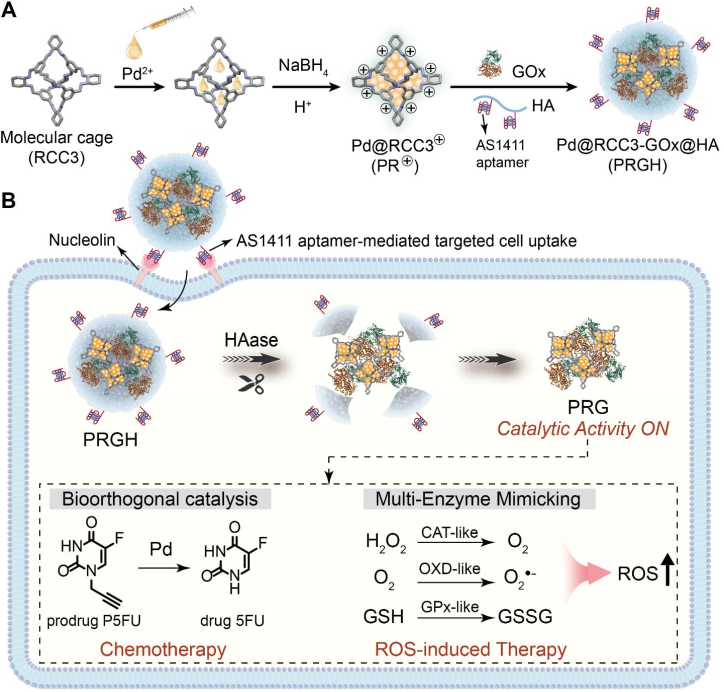
基于Pd的細胞內催化策略在調節生物過程和疾病治療等方面吸引了研究者的廣泛關注。然而,鈀納米顆粒(Pd NPs)的活性位點有限以及較差的水溶性等問題仍會導致其催化效率不夠理想,并且具有“always on”的催化活性。有鑒于此,華東師范大學王辰研究員、胡竹斌研究員和以色列希伯來大學Itamar Willner開發了一種基于Pd NPs、分子籠限域的高性能納米復合材料,并將其與葡萄糖氧化酶(GOx)和AS1411適配體修飾的透明質酸(HA)相結合。
本文要點:
(1)籠化限域策略能夠簡便合成具有更可及的活性位點的Pd NPs,以顯著提高Pd NPs的催化活性,增強生物正交催化。研究發現,該納米復合材料可響應腫瘤環境中的酸性pH和過表達的透明質酸酶,進而能夠表現出靶向能力和可激活的活性,以實現選擇性藥物合成。
(2)此外,該納米復合材料還具有類CAT,類OXD和類GPx等活性,可促進ROS生成和細胞內GSH消耗,以提高氧化應激,增強治療效果。綜上所述,該研究通過籠化限域策略構建了一種高性能金屬基細胞內催化系統,有望為合成用于疾病治療的分子提供一個新的方法。
Jiadong Tang. et al. An Activatable Caged Palladium Nanocomposite for Targeted Cancer Therapy. Angewandte Chemie International Edition. 2025
DOI: 10.1002/anie.202503485
https://onlinelibrary.wiley.com/doi/10.1002/anie.202503485



















