開(kāi)發(fā)能夠定制藥物組合的無(wú)載體藥物遞送系統(tǒng)(CDDS),并且在保持治療效果的同時(shí)實(shí)現(xiàn)有效的共組裝是當(dāng)前研究面臨的一項(xiàng)嚴(yán)峻挑戰(zhàn)。有鑒于此,四川大學(xué)曹俊研究員設(shè)計(jì)了一種基于分子工程化的共組裝策略。
本文要點(diǎn):
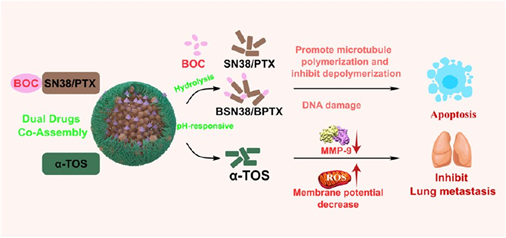
(1)實(shí)驗(yàn)利用叔丁氧羰基(BOC)對(duì)紫杉醇(PTX)和7-乙基-10-羥基喜樹(shù)堿(SN38)進(jìn)行化學(xué)修飾,并通過(guò)質(zhì)子核磁共振和質(zhì)譜分析證實(shí)了BOC基團(tuán)的成功結(jié)合。偏振光顯微鏡和X射線衍射等表征結(jié)果進(jìn)一步顯示,這種修飾能夠顯著降低兩種藥物的結(jié)晶度,并同時(shí)破壞它們?cè)械挠行蚨询B結(jié)構(gòu)。分子動(dòng)力學(xué)模擬表明,BOC修飾能夠增加分子間距,降低分子堆積密度,擴(kuò)大分子體積,導(dǎo)致分子堆積排列更加松散。研究發(fā)現(xiàn),這種結(jié)構(gòu)改變使得修飾后的藥物分子能夠以近乎預(yù)定的質(zhì)量比與α-生育酚琥珀酸酯(α-TOS)有效結(jié)合,形成球形納米顆粒。
(2)該納米顆粒的載藥量高達(dá)52.66%,其在4℃條件下能夠保持50天以上的穩(wěn)定性,并且可以在pH 5.0時(shí)表現(xiàn)出可控的釋放特性。體內(nèi)外實(shí)驗(yàn)結(jié)果表明,BOC修飾的藥物能夠保持其生物活性。與α-TOS共組裝后,該納米顆粒可通過(guò)下調(diào)基質(zhì)金屬蛋白酶-9(MMP-9)的表達(dá)產(chǎn)生顯著的協(xié)同抗腫瘤作用,抑制腫瘤轉(zhuǎn)移。綜上所述,該研究設(shè)計(jì)的在分子尺度調(diào)控藥物共組裝的策略能夠?yàn)殚_(kāi)發(fā)高效的CDDS提供堅(jiān)實(shí)的理論基礎(chǔ)和創(chuàng)新途徑。
Xuequan Zhang. et al. tert-Butoxycarbonyl-Modification Driven Disturbance of Molecular Ordering Enables High-Efficiency Dual Drugs Co-Assembly for Synergistic Tumor Inhibition. ACS Nano. 2025
DOI: 10.1021/acsnano.4c16986
https://pubs.acs.org/doi/10.1021/acsnano.4c16986



















