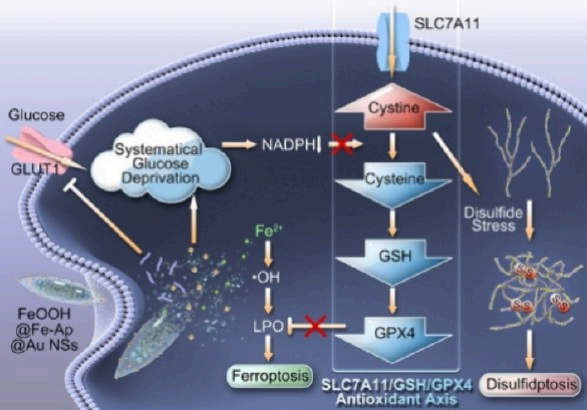
雙硫死亡和鐵死亡是最近發現的能夠用于腫瘤治療的程序性細胞死亡形式,兩者都高度依賴于細胞內胱氨酸/半胱氨酸在胱氨酸轉運體溶質載體家族7成員11/谷胱甘肽/谷胱甘肽過氧化物酶4(SLC7A11/GSH/GPX4)抗氧化軸上的轉化。然而,由于胱氨酸轉運對它們的作用相反,因此雙硫死亡和鐵死亡通常是不同步的。有鑒于此,吉林大學張皓教授、張松靈教授和Lanlan Wan證明了通過抑制上游葡萄糖攝取和促進下游葡萄糖消耗實現的系統性葡萄糖剝奪可同步引起雙硫死亡和鐵死亡。
本文要點:
(1)實驗利用共負載Au納米點和Fe-芹菜素(Ap)復合物的FeOOH納米梭(FeOOH@Fe-Ap@Au NSs)調節SLC7A11/GSH/GPX4軸,以實現雙硫死亡和鐵死亡介導的腫瘤治療。研究發現,具有類葡萄糖氧化酶活性的Au納米點可以消耗大量葡萄糖。與此同時,Ap能夠通過下調葡萄糖轉運蛋白1以抑制葡萄糖攝取,進而能夠從根本上剝奪葡萄糖。
(2)系統性葡萄糖剝奪可限制NADPH的補充,抑制SLC7A11/GSH/GPX4軸上胱氨酸/半胱氨酸的轉化,以解決胱氨酸轉運在雙硫死亡和鐵死亡中的矛盾。此外,通過FeOOH@Fe-Ap@Au NSs有效遞送外源性鐵離子以及通過Au納米點催化葡萄糖氧化自供應H2O2可協同促進細胞內Fenton反應,從而有助于增強鐵死亡。實驗結果表明,FeOOH@Fe-Ap@Au NSs可在卵巢癌模型中通過同時誘導雙硫死亡和鐵死亡表現出良好的療效。
Mengsi Zhang. et al. Synchronously Evoking Disulfidptosis and Ferroptosis via Systematical Glucose Deprivation Targeting SLC7A11/GSH/GPX4 Antioxidant Axis. ACS Nano. 2025
DOI: 10.1021/acsnano.5c00730
https://pubs.acs.org/doi/10.1021/acsnano.5c00730



















