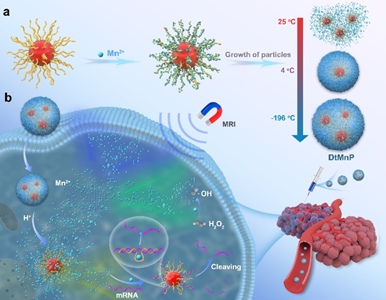
基于DNAzyme的診療納米技術可以響應特定的腫瘤病理生理參數,其為實現腫瘤診斷和有效治療提供了一個新的方法。然而,該策略的臨床轉化目前仍會受到DNAzyme激活所需的必需金屬輔助因子的胞內可用性不足等問題的阻礙。有鑒于此,中國科學院生態環境研究中心彭漢勇研究員開發了一種溫控合成策略,并將其用于制備多功能DNA模板化碳酸錳納米顆粒(DtMnP)。
本文要點:
(1)該過程包括三個關鍵階段:(i)球形核酸雜化體和DNAzyme功能化的AuNP可作為支架以通過磷酸鹽配位實現空間可控的Mn2+沉積,引發MnCO3的非均相成核;(ii)快速液氮冷凍誘導納米顆粒沿DNA模板生長;(iii)凍干介導的結構穩定可以實現長期儲存。在腫瘤微環境條件(pH 5.5)下,DtMnP能夠表現出響應pH的溶解行為,其在60分鐘內可釋放90%的Mn2+。
(2)釋放的Mn2+離子具有雙重功能:(i)可在MCF-7異種移植腫瘤模型中表現出優越的磁共振成像(MRI)對比度和增強的生物安全性;(ii)通過DNAzyme介導的EGR-1基因沉默(60% mRNA下調)和Mn2+催化Fenton反應產生的細胞毒性羥基自由基(45% MCF-7細胞凋亡)實現協同治療效果。綜上所述。該研究構建的低溫封裝DtMnP可以將多種功能成分集成到單個納米顆粒中,以實現高效的腫瘤治療。
Wenjing Xie. et al. Spherical Nucleic Acids Directed Cryo-Synthesis of Manganese Nanoagents for Tumor Imaging and Therapy. Angewandte Chemie International Edition. 2025
DOI: 10.1002/anie.202503004
https://onlinelibrary.wiley.com/doi/10.1002/anie.202503004



















