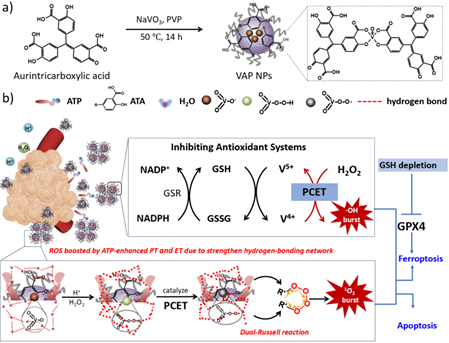
與傳統(tǒng)的細(xì)胞凋亡的難治性相比,癌細(xì)胞代謝重編程所暴露的脆弱性為鐵死亡治療提供了一個(gè)獨(dú)特的優(yōu)勢。有鑒于此,中國科學(xué)院長春應(yīng)化所姜秀娥研究員開發(fā)了釩酸鹽和金精三羧酸配位的納米顆粒(VAP NPs),并將其用于協(xié)同觸發(fā)雙重細(xì)胞死亡通路。
本文要點(diǎn):
(1)在腫瘤微環(huán)境(TME)中,該納米平臺(tái)可利用雙重羅素機(jī)制和芬頓反應(yīng)產(chǎn)生單線態(tài)氧/羥基自由基,并同時(shí)通過釩氧化還原循環(huán)消耗谷胱甘肽,以沉默谷胱甘肽過氧化物酶4,并調(diào)節(jié)Kelch樣ECH關(guān)聯(lián)蛋白1(KEAP1)/ 核因子E2相關(guān)因子2(NRF2)/血紅素加氧酶1(HMOX1)軸。
(2)研究發(fā)現(xiàn),TME過表達(dá)的三磷酸腺苷(ATP)可作為生化催化劑,其在活性氧的生成過程中能夠加速質(zhì)子和電子的轉(zhuǎn)移,以增強(qiáng)治療效果。實(shí)驗(yàn)結(jié)果表明,VAP NPs可以在腫瘤治療過程中發(fā)揮刺激鐵死亡和細(xì)胞凋亡的協(xié)同效應(yīng)的重要作用。綜上所述,該研究能夠?yàn)榻沂続TP增強(qiáng)氧化還原代謝調(diào)控的功能提供了新的參考。
Shangjie An. et al. ATP-Assisted Electron and Proton Transfer Boosting Redox Metabolism-Induced Ferroptosis and Apoptosis for Cancer Therapy. Angewandte Chemie International Edition. 2025
DOI: 10.1002/anie.202504542
https://onlinelibrary.wiley.com/doi/10.1002/anie.202504542




















