實現對自身免疫性疾病的抗原特異性免疫治療是一個重要但仍未實現的臨床需求。有鑒于此,廈門大學劉超教授和劉剛教授利用表觀遺傳重編程構建了一種新型的反向疫苗平臺,其可誘導持久的抗原特異性免疫耐受。
本文要點:
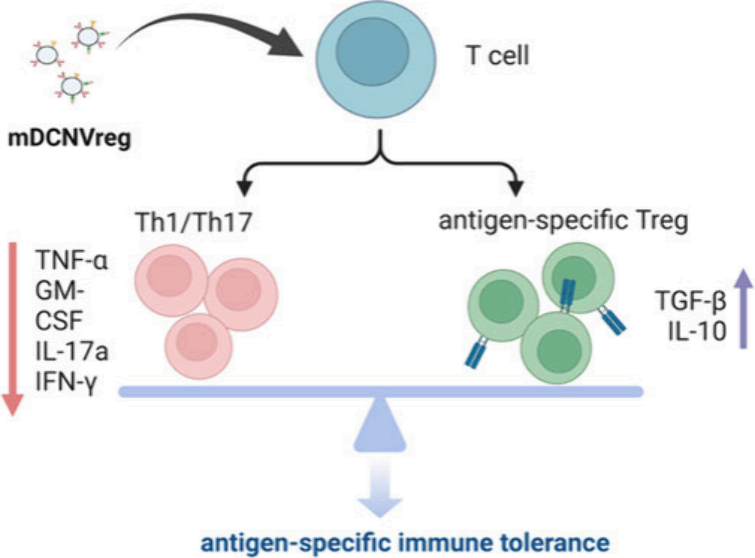
(1)實驗利用經過表觀遺傳調控、IFN-γ啟動的調節性樹突狀細胞源性人工細胞膜納米囊泡構建了該反向疫苗(mDCNVreg)。工程化的mDCNVreg具有MHC-II表達上調(可實現靶向抗原呈遞)、抑制的共刺激分子表達和增強的共抑制分子展示等特點。研究發現,該平臺可通過增強的淋巴運輸和表型穩定的協調機制顯著增強抗原向次級淋巴器官的遞送,并同時保持耐受性效力。
(2)實驗結果表明,mDCNVreg可通過表位特異性相互作用直接誘導CD4+ T細胞克隆無能,以建立持久的免疫耐受。綜上所述,該研究開發了一種表觀遺傳工程化方法,有望為設計反向疫苗以實現對自身免疫性疾病的個性化治療提供新的見解。
Yue Xi. et al. Epigenetically Reprogrammed Nanovesicles as Inverse Vaccines for Antigen-Specific Immune Tolerance in Autoimmune Diseases. Nano Letters. 2025
DOI: 10.1021/acs.nanolett.5c00986
https://pubs.acs.org/doi/10.1021/acs.nanolett.5c00986



















