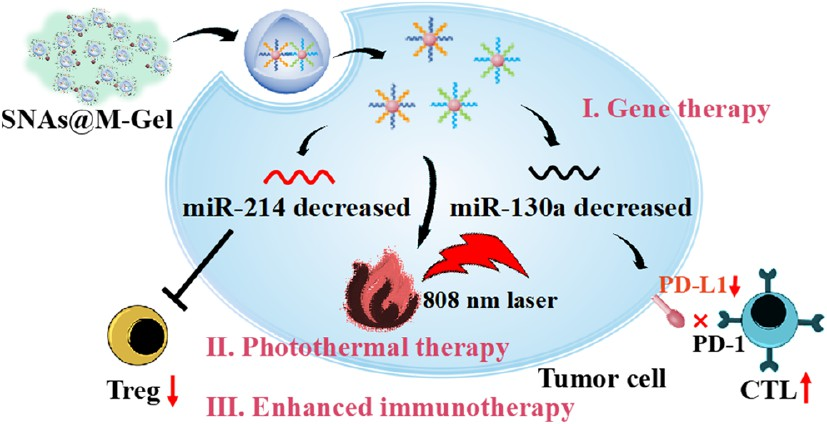
在惡性腫瘤的免疫治療過程中,效應(yīng)T細(xì)胞和調(diào)節(jié)性T細(xì)胞(Tregs)之間的平衡失調(diào)以及個體差異導(dǎo)致的療效不確定是兩個亟待解決的問題。有鑒于此,西安交通大學(xué)陳鑫教授和張彥民教授設(shè)計了一種可注射的納米復(fù)合水凝膠系統(tǒng)(SNAs@M-Gel),其能夠通過刺激反應(yīng)性調(diào)節(jié)多種腫瘤相關(guān)microRNA抑制Treg增殖,并有效阻斷PD-1/PD-L1介導(dǎo)的免疫逃避。
本文要點:
(1)該系統(tǒng)能夠?qū)崿F(xiàn)依賴于microRNA的光熱免疫治療,是一種高效、個性化的腫瘤治療方法。實驗以氧化海藻酸鈉(OSA)和癌細(xì)胞膜(CCM)包封的球形核酸納米粒子(SNAs@M)作為前體,利用對pH敏感的席夫堿鍵的形成和內(nèi)源性鈣離子(Ca2+)交聯(lián)在腫瘤部位原位構(gòu)建了SNAs@M-Gel水凝膠。在治療期間,SNAs@M-Gel可在局部長期保留(長達(dá)10天),并將SNAs@M納米顆粒連續(xù)釋放到腫瘤微環(huán)境中。研究發(fā)現(xiàn),SNAs@M可通過CCM的靶向能力精準(zhǔn)進(jìn)入腫瘤細(xì)胞,并與過表達(dá)的miR-214和miR-130a發(fā)生特異性雜交,導(dǎo)致腫瘤細(xì)胞上的PD-L1表達(dá)顯著下調(diào),恢復(fù)被Tregs抑制的細(xì)胞毒性T淋巴細(xì)胞(CTL)的功能,實現(xiàn)免疫微環(huán)境重塑。
(2)此外,作為交聯(lián)劑的miRNAs也能夠促進(jìn)SNAs的聚集,直接促進(jìn)光熱制劑在腫瘤細(xì)胞內(nèi)的局部產(chǎn)生,進(jìn)而可以在近紅外(NIR)照射下實現(xiàn)具有高選擇性的光熱治療。實驗結(jié)果表明,這一系列事件不僅會破壞原發(fā)腫瘤,還能夠誘導(dǎo)大量腫瘤相關(guān)抗原的釋放,以觸發(fā)鄰近樹突狀細(xì)胞(DCs)的成熟和腫瘤特異性CTLs的啟動,并同時消耗Tregs,以逆轉(zhuǎn)促腫瘤免疫微環(huán)境,增強(qiáng)光熱免疫療法的整體治療效果。
Li Chen. et al. Remodeling of Effector and Regulatory T Cells by Capture and Utilization of miRNAs Using Nanocomposite Hydrogel for Tumor-Specific Photothermal Immunotherapy. ACS Nano. 2025
DOI: 10.1021/acsnano.4c18801
https://pubs.acs.org/doi/10.1021/acsnano.4c18801




















