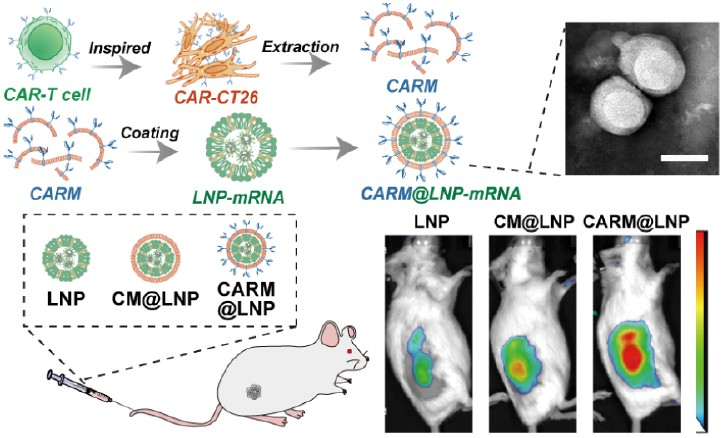
基于mRNA的基因療法進一步推動了癌癥治療的發展。然而,腫瘤靶向遞送方法有限等問題仍會嚴重限制該策略的臨床應用,并且會導致脫靶效應和安全性風險。嵌合抗原受體(CAR)分子使T細胞能夠以不依賴主要組織相容性復合物的方式識別特定抗原。CAR方法為細胞膜引入額外的靶向功能提供了一種有效的解決方案。具有同型腫瘤靶向特性的癌細胞膜包被納米粒子為基因工程和膜提取提供了一個重要平臺。有鑒于此,四川大學Ke Men、Wei Wang和電子科技大學段醒妹教授構建了一個仿CAR的癌細胞膜包被平臺,其可通過雙重腫瘤靶向機制遞送mRNA制劑。
本文要點:
(1)研究者利用簡化的人表皮生長因子受體2(HER2)特異性CAR分子(包括細胞外HER2結合結構域、鉸鏈區和跨膜結構域)對癌細胞的細胞膜進行工程化,以構建CAR-CT26細胞。隨后,研究者將提取的CAR-CT26膜(CARM)包覆在脂質納米顆粒(LNP)-mRNA表面,以形成CARM@LNP-mRNA復合物。在體外,CARM包被的納米顆粒能夠在過表達靶HER2抗原的CT26細胞中表現出更高的mRNA轉染效率。
(2)在HER2+ CT26皮下腫瘤和腹腔轉移模型中,與CT26細胞膜包被的對照組相比,系統給藥的CARM@LNP-mRNA制劑能夠表現出更強的腫瘤靶向能力和腫瘤抑制作用。實驗結果表明,CARM@LNP是實現基于mRNA的基因療法的可行選擇。綜上所述,該研究開發的CARM@LNP-mRNA能夠為實現腫瘤靶向治療提供一個新的策略。
Sibei Lei. et al. Chimeric Antigen Receptor-Engineered Cell Membrane-Coated Nanoparticles Promote Dual-Targeted mRNA-Based Cancer Gene Therapy. ACS Nano. 2025
DOI: 10.1021/acsnano.4c18153
https://pubs.acs.org/doi/10.1021/acsnano.4c18153




















