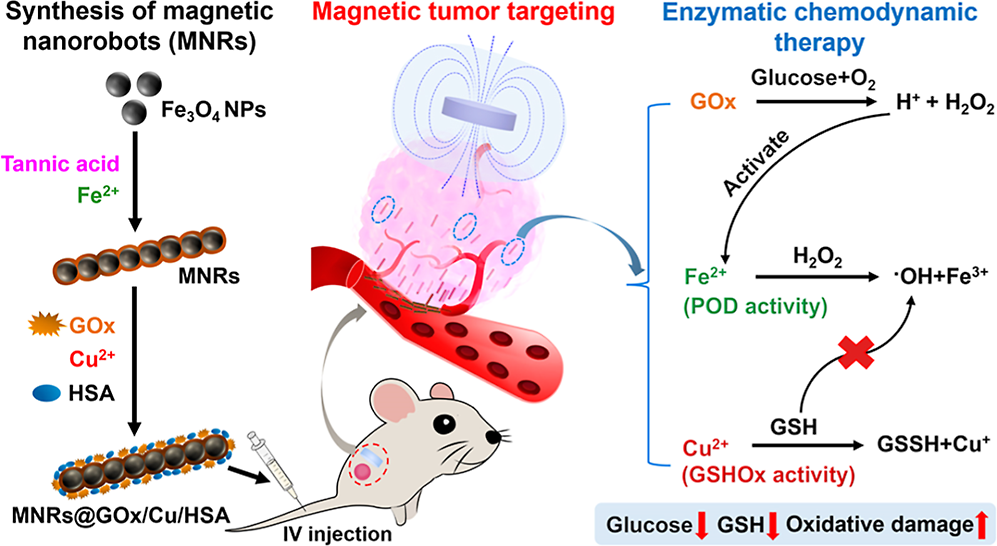
將治療藥物靶向遞送到惡性組織是提高臨床療效和減少副作用的關鍵。磁性納米機器人(MNRs)是一種極具發展前景的控制遞送策略,其能夠利用外部磁場實現精準的體內靶向。有鑒于此,南洋理工大學段宏偉教授、浦侃裔教授和江南大學梁麗教授開發了由金屬-多酚復合物(MPCs)連接、線性排列的磁性納米顆粒組成的細長MNRs,并將其用于實現磁場定向的腫瘤主動靶向和協同腫瘤治療。
本文要點:
(1)在均勻磁場下,研究者通過將30 nm的Fe3O4納米顆粒、單寧酸和鐵離子(Fe2+)進行組裝構建了MNRs,其能夠形成由MPCs固定的細長鏈狀結構,并且具有增強的類過氧化物酶活性。與單個納米顆粒相比,該結構能夠表現出更強的磁響應性能,可實現靈活的磁調控。
(2)MPCs包覆層可利用葡萄糖氧化酶,銅離子(Cu2+)和人血清白蛋白(HSA)實現定制的表面修飾,以制備得到膠體穩定的MNRs(MNRs@GOx/Cu/HSA),其可通過多酶級聯作用消耗葡萄糖,產生?OH,并消耗抗氧化劑谷胱甘肽(GSH)。實驗結果表明,表面工程化多功能MNRs可在外部磁場的驅動下表現出增強的體內腫瘤靶向性,以實現有效的局部化學動力學治療。綜上所述,該研究開發的具有定制結構和功能特性的MNRs在靶向藥物遞送、微創手術和疾病的局部治療等方面具有廣闊的應用前景。
Di Li. et al. Elongated Magnetic Nanorobots with Multi-Enzymatic Cascades for Active In Vivo Tumor Targeting and Enhanced Chemodynamic Therapy. ACS Nano. 2025
DOI: 10.1021/acsnano.5c01566
https://pubs.acs.org/doi/10.1021/acsnano.5c01566



















