腫瘤乏氧和細胞凋亡逃逸之間的自持續(xù)反饋循環(huán)會嚴重影響腫瘤放療的有效性。有鑒于此,中國醫(yī)學科學院北京協(xié)和醫(yī)學院劉鑒峰研究員、黃帆研究員和南開大學劉陽教授開發(fā)了一種腫瘤特異性激活的聚合物納米調(diào)諧器,其可通過破壞這種惡性循環(huán)提高放療的治療效果。
本文要點:
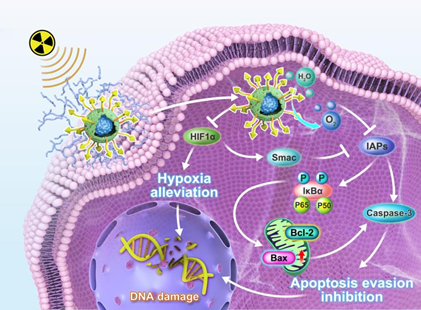
(1)實驗設(shè)計的納米調(diào)諧器由促凋亡肽工程化的過氧化氫酶內(nèi)核和pH分離的聚合物外殼組成,其可以在“關(guān)閉”狀態(tài)下維持核殼結(jié)構(gòu),以抵抗免疫清除和酶降解。當?shù)竭_腫瘤部位后,該納米調(diào)諧器可通過解離聚合物外殼保持酸響應(yīng)“開啟”特性,促進被暴露的功能內(nèi)核的腫瘤積累和細胞內(nèi)化。研究發(fā)現(xiàn),被內(nèi)化的聚合物納米調(diào)諧器內(nèi)核能夠有效地將內(nèi)源性過氧化氫(H2O2)分解為氧氣(O2)以緩解乏氧,進而上調(diào)促凋亡蛋白Smac的表達。
(2)在內(nèi)核表面修飾的凋亡誘導肽可進一步增強Smac誘導的凋亡信號,干預腫瘤細胞凋亡逃避,最終能夠通過阻斷這一惡性循環(huán)實現(xiàn)顯著的放射治療效果。體內(nèi)研究表明,該聚合物納米調(diào)諧器治療能夠顯著增強輻射介導的腫瘤消融,并且不會產(chǎn)生明顯的副作用。綜上所述,該研究開發(fā)的策略能夠通過特異性干擾反饋周期克服腫瘤放射耐藥,有望為實現(xiàn)安全有效的癌癥治療開辟一條新的途徑。
Xiaoxue Hou. et al. Tumor-Specific Activated Polymeric Nanotuners Disrupt Positive Feedback Cycle of Hypoxia and Apoptosis Evasion for Potent Cancer Radiotherapy. Biomaterials. 2025
https://www.sciencedirect.com/science/article/pii/S0142961225002807



















