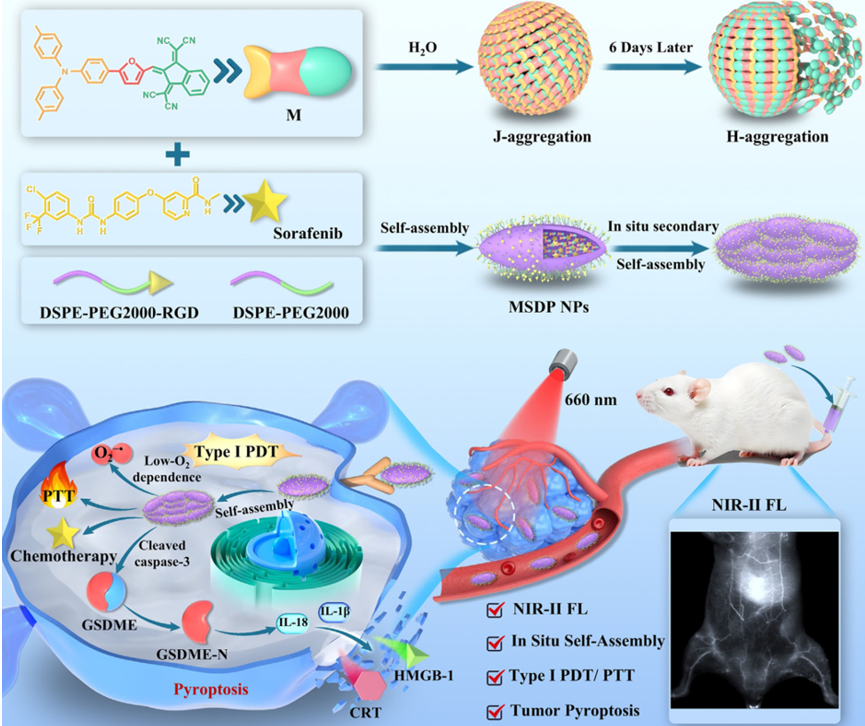
焦亡是一種程序性細胞死亡機制,其可避免細胞凋亡抵抗,并引發腫瘤特異性免疫反應,是一種重要的癌癥治療方法。盡管納米藥物能夠改善小分子藥物的腫瘤富集和體內循環,但其仍面臨組織穿透性差、腫瘤耐藥性和乏氧微環境等嚴峻挑戰。有鑒于此,東南大學李全教授設計了一種基于近紅外二區(NIR-II)J-聚集體的新型納米藥物,并利用原位二次自組裝策略構建了具有高靶向性的納米顆粒(MSDP NPs)。
本文要點:
(1)該納米藥物能夠通過產生I型活性氧(特別是超氧陰離子)引發焦亡,并同時激活光免疫療法。研究發現,在腫瘤部位的原位二次自組裝可實現由J聚集體驅動的微尺度紡錘狀纖維束形成,以促進MSDP NPs實現有效的腫瘤穿透,并延長其在腫瘤中的保留時間。
(2)這種獨特的結構轉變能夠增強納米藥物在腫瘤組織中的積累,實現強大的NIR-II熒光成像,即使在乏氧的腫瘤微環境中也能夠有效提高治療效果。綜上所述,該研究設計了一種創新的光學診療策略,即利用NIR-II J聚集體的原位二次自組裝誘導腫瘤焦亡,有望為解決納米藥物在癌癥治療領域中存在的局限性問題提供一個有效的解決方案。
Yuqi Tang. et al. In Situ Secondary Self-Assembly of Near-Infrared II J-Aggregates: A Novel Phototheranostic Strategy for Inducing Tumor Pyroptosis. Advanced Materials. 2025
DOI: 10.1002/adma.202501184
https://advanced.onlinelibrary.wiley.com/doi/10.1002/adma.202501184



















